课程内容
《开发利用金属矿物和海水资源》
一、开发利用金属矿物
金属的存在有什么规律吗?
少数化学性质不活泼的金属,在自然界中能以游离态存在,如金和铂以及少量的银和铜,较活泼的铁只能存在于陨石中,而化学性质活泼的金属,在自然界中总是以化合态存在。但在实际生产和生活中应用的金属材料却往往是纯金属或合金,这就需要把金属从金属矿物中提炼出来,这就叫做金属的冶炼。
思考:
1、金属冶炼指什么?
2、为什么不同金属的冶炼方法不同?
3、金属活动顺序与金属冶炼有什么关系?
金属冶炼的一般方法:
1、热分解法——金属活动性顺序表中氢以后的金属
2、热还原法——大多数金属(活动性介于Zn-Cu的金属)
3、电解法——(钾、钙、钠、镁、铝等活泼金属的冶炼)
【实验4-1】
镁条的燃烧为铝热剂提供高温条件,氯酸钾为镁条继续燃烧提供氧。
铝热剂:金属铝与镁、钴、镍、锰等的氧化物的混合物。
现象:镁条激烈燃烧,发出白光,导致混合物激烈反应过后,有红热的铁水生产。
铝与氧化铁反应的化学方程式:2Al+Fe2O3==(高温)2Fe+Al2O3
金属矿物资源有限合理利用矿物资源
途径:提高金属矿物的利用率
减少金属的使用量
加强金属资源的回收和再利用
使用其他材料代替金属材料
二、海水资源
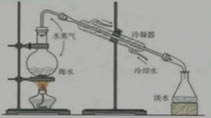
1、海水水资源的利用——海水淡化
海水蒸馏原理示意图
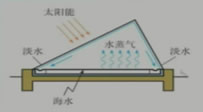
太阳能蒸发海水示意图:
2、海水化学资源的开发利用
——海水提NaCl
【实验4-2】如何证明海带中存在碘元素
实验现象:加入H2O2后,溶液由无色变为深黄色,加入淀粉溶液后,溶液又变为深蓝色
化学方程式:2KI+H2O2+H2SO4=I2+K2SO4+2H2O
科学探究
将Br-转变为Br2是海水提溴中关键的化学反应,你能否设计一个实验方案模拟这一过程?写出有关反应的化学方程式。
浓缩海水→(通Cl2)→溴单质→(通空气、水蒸气,SO2吸收)→氢溴酸→(通氯气)→溴单质
2NaBr+Cl2=2NaCl+Br2
Br2+SO2+2H2O=2HBr+H2SO4
2HBr+Cl2=2HCl+Br2
此内容正在抓紧时间编辑中,请耐心等待
刘老师
男,中教高级职称
工作勤奋,责任心强,多次被评为市优秀教师。