课程内容
《醛》
教学目标:
1、掌握乙醛的主要化学性质。
2、了解乙醛的物理性质和用途。
3、了解醛的分类和命名。
4、理解饱和一元醛的一般通性和同分异构现象。
重点:乙醛的化学性质
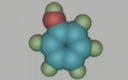
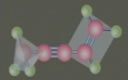
一、乙醛的分子结构
分子式:C2H4O
结构式:
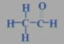
结构简式:CH3CHO
官能团:醛基:-CHO
二、乙醛的物理性质
乙醛是无色、有刺激性气味的液体,密度比水小,易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
三、乙醛的化学性质
(1)加成反应
根据加成反应的概念写出CH3CHO和H2加成反应的方程式。
这个反应属于氧化反应还是还原反应?
有机反应中的氧化反应和还原反应,我们应该怎样判断呢?
还原反应:有机物分子中加入氢原子或失去氧原子的反应。
氧化反应:有机物分子中加入氧原子或失去氢原子的反应。
醇类发生催化氧化的条件是什么?
1、Ag或Cu作催化剂并加热。
2、羟基所连的碳原子上有氢原子。
(2)氧化反应
a、催化剂
b、燃烧
c、被弱氧化剂氧化
Ⅰ 银镜反应
1、配制银氨溶液:取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
2、水浴加热形成银镜:在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
银镜反应注意事项:
(1)试管内壁必须洁净;
(2)必须水浴;
(3)加热时不可振荡和摇动;
(4)必须新配制的银氨溶液;
(5)乙醛用量不可太多;
(6)试验后,银镜用HNO3浸泡,再用水洗。
Ⅱ 与新制的氢氧化铜反应
现象:有红色(Cu2O)沉淀生成
注意:强氧化铜溶液一定要新制,碱一定要过量。
应用:检验醛基的存在,医学上检验病人是否患糖尿病
四、醛
从结构上看,由烃基(或氢原子)跟醛基相连而成的化合物叫醛。
1、醛的同分异构现象
除本身的碳架异构外,醛与酮、烯醇、环醇互为同分异构体。
2、饱和一元醇的通式:CnH2n+1CHO或CnH2nO
3、化学性质
(1)和H2加成被还原成醇
(2)氧化反应
a、燃烧
b、催化氧化成羧酸
c、被弱氧化剂氧化 Ⅰ 银镜反应 Ⅱ 与新制的氢氧化铜反应
d、是酸性KMnO4溶液和溴水褪色
五、甲醛
结构式:
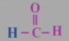
分子式:CH2O
结构简式:HCHO
物理性质:无色,有强烈刺激性气味的气体,易溶于水
应用:重要的有机合成原料,其水溶液(福尔马林)有杀菌和防腐能力。
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教中级职称
善于因材施教,针对不同学生的心理,采用不同的教学方法,以求达到更好的学习境界。