课程内容
《氨 硝酸 硫酸(一)》
【教学目标】
一、知识与能力:
1、掌握氨的化学性质、铵盐的性质;
2、掌握氨气的实验室制法;
过程与方法:
1、通过对实验的观察和分析,培养观察能力,思维能力和应用化学实验发现学习新知识的能力。
2、通过引导学生设计实验、操作实验激发学生对化学的兴趣,提高探索新知识的欲望。
情感态度价值观:
不断引导学生发挥主观能动性,自行归纳整理知识线索交流学习方法,建立自信心,培养自信心,培养创新精神,并尝试创造喜悦。
二、氮的固定
1、定义:将游离的氮的化合物的过程
2、方法:
(1)自然固氮:雷雨固氮 生物固氮(根瘤菌固氮)
(2)人工固氮:合成或工业等
制取氨气:
喷泉实验:考考你的观察能力
现象:烧杯里的液体由玻璃管进入烧瓶,形成美丽的喷泉:烧瓶中的液体呈红色。
原因:①氨气极易溶于水(1:700),使烧瓶气压急剧下降。
②氨气水溶液呈碱性。
二、氨
1、氨气的化学性质:
(1)氨气与水的反应: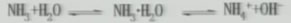
思考:氨水中存在哪些分子、哪些离子?
分子:NH3、H2O、NH3·H2O(主要)
离子:NH4+、OH-、微量H+
氨水的性质:①弱电解质 ②易挥发,不稳定,易分解
保存:棕色试剂瓶、密封
(2)NH3与酸的反应
【实验】用玻璃棒蘸浓氨水,与蘸有浓盐酸的玻璃棒靠近,有何现象?为什么?
现象:产生大量白烟 NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3
2NH3+H2SO4=(NH4)2SO4
(3)NH3的还原性
2、铵盐
①铵盐都易溶于水 ②铵盐受热易分解 ③铵盐与碱反应放出氨气
一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
3、氨的实验室制法
(1)试剂:氯化铵晶体、消石灰固体
(2)原理:2NH4Cl+Ca(OH)2=(加热)CaCl2+2H2O+2HN3↑
(3)装置:固+固加热(与氧气的制取装置相同)
(4)收集:向下排空气法
(5)验满:湿润的红色石蕊试纸变蓝(常见唯一碱性气体)
(6)尾气吸收:稀硫酸溶液
棉花的作用:防止空气对流,提高集气的速度和纯度。
干燥氨气的常用试剂:CaO、碱石灰等碱性干燥剂
注意:无水CaCl2不等干燥NH3(形成CaCl2·8NH3)
氨的用途
制氮肥铵盐、制硝酸纯碱、有机合成工业原料、制冷剂
讨论:氨是制硝酸的重要原料,如果以氨气、空气、水为原料,如何实现由氨到硝酸的转化?
讨论:假如你正处在液氨泄露的现场,你将如何去做?
此内容正在抓紧时间编辑中,请耐心等待
关老师
男,中教高级职称
拥有丰富的备考经验,思路清晰,在教学方法和解题技巧上见解突出,总能把重点、难点化繁为简。
















