课程内容
《弱电解质的电离》
根据实验现象,讨论下列问题
(1)镁条和酸的反应的实质是什么?影响反应速率的因素是什么?
(2)当酸溶液的物质的量浓度相等时,溶液中的H+浓度是否相等?怎么判断?
(3)为什么相同体积、相同浓度的盐酸和醋酸中,H+浓度却不同?
一、强弱电解质
1、定义
强电解质:在水溶液能完全电离成离子的电解质。
弱电解质:在水溶液里部分电离成离子的电解质。
强电解质与弱电解质的比较
强电解质
弱电解质
相同点
都是电解质,在溶液中都能电离
电离程度
完全电离
部分电离
电离过程
不可逆过程
可逆过程
表示方法
电离方程式用等号
电离方程式用可逆符号
电解质在溶液中微粒形式
水合离子
分子、水合离子
问题探讨:电解质的强弱与其溶解性和溶液的导电能力有何关系?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。
2、分类

3、电离方程式的书写:表示电解质电离的式子。
①强电解质在溶液中全部电离,在电离方程式中以“=”表示之;
②弱电解质不能全部电离,在电离方程式中以“ ”表示之;
”表示之;
③多元弱酸分步电离,在书写电离方程式时要分步书写。
④多元弱碱分步电离,但常常写成一步。
醋酸是一种弱电解质,在水溶液中的电离是个可逆过程,请根据化学平衡的有关原理思考:当醋酸溶于水后,醋酸电离的速率与CH3COO-、H+结合成醋酸分子的速率会有何变化?
二、弱电解质的电离平衡:
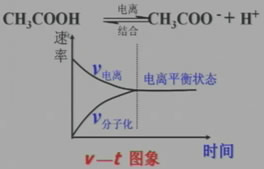
1、定义:在一定条件下(温度、压强),当弱电解质电离成离子的速率和离子结合成弱电解质分子的速率相等时,达到了电离平衡。
2、特征:
等:v电离=v结合
定:平衡后溶液中各分子、离子的浓度不变。
动:动态平衡
变:条件改变,平衡可能发生移动
【思考】0.1mol/L的CH3COOH溶液中CH3COOH CH3COO-+H+
CH3COO-+H+
电力程度
n(H+)
C(H+)
C(Ac-)
C(HAc)
加水
增大
增大
减小
减小
减小
加冰醋酸
减小
增大
增大
增大
增大
加错酸钠
减小
减小
减小
增大
增大
通HCl
减小
增大
增大
减小
增大
加NaOH
增大
减小
减小
增大
减小
锌粒
增大
减小
减小
增大
减小
升温
增大
增大
增大
增大
减小
3、影响电离平衡的外界条件:
浓度:
①改变弱电解质浓度
a、加水稀释:正向移动,电离程度增加。
b、增大浓度:正向移动,电离程度减小。
②增大生成的离子的浓度(同离子效应):逆向移动
③减小生成的离子的浓度:正向移动
温度:电离吸热,升高温度,平衡正向移动
练习
1、在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
2、写出下列物质在水溶液中的电离方程式。
HCl
NH3·H2O
Fe(OH)3
H2CO3
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。























