课程内容
《水的电离和溶液的酸碱性》
一、水的电离
1、水是一种极弱的电解质,能微弱的电离:
H2O+H2O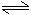 H3O++OH-
H3O++OH-
(H2O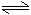 H++OH-)
H++OH-)
平衡常数:K电离=C(H+)×C(OH-)/C(H2O)
在室温下1L水中只有1×10-7mol水电离,电离前后水的物质的量几乎不变,C(H2O)可视为常数
所以K电离×C(H2O)=C(H+)×C(OH-)=Kw
2、水的离子积
在一定温度时:
C(H+)×C(OH-)=Kw,叫水的离子积。
25℃时,C(H+)=C(OH-)=1×10-7mol/L
Kw=1×10-14
温度越高,Kw越大,水的电离是一个吸热过程。
3、影响水电离的因素
(1)加入酸或碱,抑制水的电离,Kw不变;
(2)升高温度,电离过程是一个吸热过程,促进水的电离,水的离子积增大,在100℃时,Kw=5.5×10-13。
思考与交流
常温下,比较下列情况下,c(H+)和c(OH-)的值或变化趋势(增加或减少):
纯水
加少量盐酸
加少量氢氧化钠
c(H+)
10-7mol/L
变大
变小
c(OH-)
10-7mol/L
变小
变大
c(H+)和c(OH-)大小比较
c(H+)=c(OH-)
c(H+)>c(OH-)
c(H+)<c(OH-)
二、溶液的酸碱性
c(H+)=c(OH-) 中性溶液 c(H+)=1×10-7mol/L
c(H+)>c(OH-) 酸性溶液 c(H+)>1×10-7mol/L
c(H+)<c(OH-) 碱性溶液 c(H+)<1×10-7mol/L
这是常温下,溶液的酸碱性跟H+和OH-浓度的关系。
三、溶液的pH
1、意义:表示溶液酸碱性的强弱。
2、表示:用H+物质的量浓度的负对数来表示。
3、计算公式:pH=-lgc(H+)
如c(H+)=1×10-6mol/L的溶液 pH=6
4、pH的适用范围
c(H+)≤1mol/L和c(OH-)≤1mol/L的稀溶液。
溶液的pH——正误判断
(1)一定条件下pH越大,溶液的酸性越强。
(2)用pH表示任何溶液的酸碱性都很方便。
(3)强酸溶液的pH一定小。
(4)pH等于6一定是一个弱酸性体系。
5、溶液的pH与酸碱性
常温下,溶液的酸碱性跟pH的关系:
中性溶液 c(H+)=c(OH-) c(H+)=1×10-7mol/L pH=7
酸性溶液 c(H+)>c(OH-) c(H+)>1×10-7mol/L pH<7
碱性溶液 c(H+)<c(OH-) c(H+)<1×10-7mol/L pH>7
6、pH的测定
方法一:用pH试纸测定
使用方法:用玻璃棒蘸待测液点在pH试纸上,然后与标准比色卡比较。广泛pH试纸只能得到整数值。精密pH试纸可以精确到0.1。
pH试纸不可润湿,否则可能将待测溶液稀释了。
方法二:用pH计测定
7、pH的计算
步骤:
A、先判断溶液的酸碱性
B、若溶液为酸性,则直接求c(H+),继而求pH;
若溶液呈碱性,则必须先求溶液中c(OH-),再利用该温度下的Kw求c(H+),最后求溶液的pH。
pH计算1——酸的稀释
例题:①在25℃时,pH等于2的盐酸溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后,pH等于多少?
②在25℃时,pH等于5的盐酸溶液稀释到原来的1000倍后,pH等于8吗?
pH计算2——碱的稀释
例题:在25℃时,pH等于9的强碱溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后,pH等于6吗?
pH计算3——强酸与强酸混合
例题:在25℃时,pH等于1的盐酸溶液1L和pH等于4的硫酸溶液1000L混合,pH等于多少?
pH计算4——强碱与强碱混合
例题:在25℃时,pH=10与pH=12氢氧化钠溶液等体积混合后,溶液中c(H+)等于多少?
pH计算5——强酸与强碱混合
例题:在25℃时,100mol0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液的pH等于多少?
例题:在25℃时,100mol0.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH等于多少?
关键:碱过量抓住氢氧根离子进行计算!
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。























