课程内容
《难溶电解质的溶解平衡》
一、难溶电解质的溶解平衡
1、谈谈对部分酸、碱和盐的溶解度表中“溶”与“不溶”的理解。
2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。

·生成沉淀的离子反应之所以能够发生,在于生成物的溶解度小。
·难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存)。
·习惯上,将溶解度小于0.01克的电解质称为难溶电解质
·化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
一、难溶电解质的溶解平衡
1、沉淀溶解平衡:
(1)概念:在一定条件下,当难溶电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等时,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。溶解平衡时的溶液是饱和溶液。
(2)特征:逆、等、动、定、变
(3)影响因素:内因、外因(浓度、温度(一般))
二、沉淀反应的应用
1、沉淀的生成
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
(2)方法
a、调pH值
如:工业原料氯化铵中混有氯化铁,加氨水调pH值至7-8
b、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂。
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
2、沉淀的溶解
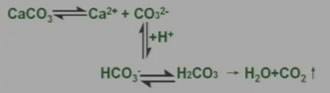
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:
3、沉淀的转化
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀。锅炉中水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
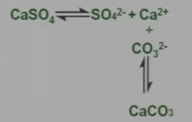
沉淀转化的实质是一般溶解度小的沉淀转化成溶解度更小的沉淀。
课堂练习
1、下列说法中正确的是( )
A、不溶于水的物质溶解度为0
B、绝对不溶解的物质是不存在的
C、某离子被沉淀完全是指该离子在溶液中的浓度为0
D、物质的溶解性为难溶,则该物质不溶于水
2、试利用平衡移动原理解释下列事实:
(1)Al(OH)3不溶于水,但能溶于稀盐酸中
(2)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。
























