课程内容
《原电池》
原电池的工作原理
一、原电池:如:Zn+Cu2+=Zn2++Cu
(1)定义:将化学能转化为电能的装置
(2)电极反应:
①负极:Zn-2e-=Zn2+(氧化反应)
电子流出的一极
②正极:Cu2++2e-=Cu(还原反应)
电子流入的一极
(3)构成原电池的条件:
极——有两种活动性不同的金属(或一种是非金属导体)作电极
液——电极材料均插入电解质溶液中
路——两极相连形成闭合电路
自——一个自发进行的氧化还原反应
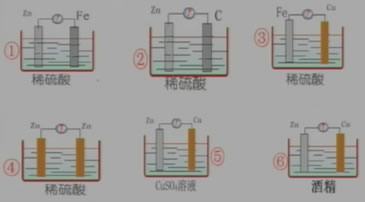
练习:判断下列哪些装置可以构成原电池。
下图所示装置也可以通过盐桥构成原电池,思考它的工作原理。
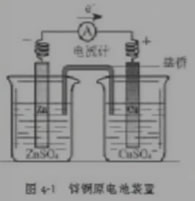
盐桥中通常装有含琼胶的KCl饱和溶液,是整个装置构成闭合体系,同时具有平衡电荷的作用。
二、原电池的正、负极的判断方法:
(1)由组成原电池的两极材料判断。
一般是活泼的金属为负极,活泼性较差的金属或能导电的非金属为正极。若一极为金属,另一极为石墨(或化合物),金属为负极。
(2)根据电流方向或电子流动方向判断。
(3)根据原电池的电解质溶液内离子的定向流动方向。
(4)根据原电池两极发生的为氧化反应还是还原反应。
(5)电极上的实验现象。
三、原电池原理的应用
(1)制作干电池、蓄电池、高能电池等。
(2)比较金属活动性强弱。
例1:下列叙述中,可以说明金属甲比乙活泼性强的是
A、甲和己用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B、在氧化-还原反应中,甲比乙失去的电子多;
C、将甲乙作电极组成原电池时甲是负极;
D、同价态的阳离子,甲比乙的氧化性强。
(3)比较反应速率:利用构成原电池可以加快化学反应速率
例2:下列制氢气的反应速率最快的是( )
A、纯铁和1mol/L硫酸;
B、纯铁和18mol/L硫酸;
C、粗铁和1mol/L硫酸;
D、粗铁和1mol/L硫酸的反应中加入几滴CuSO4溶液。
(4)用于金属的保护
(5)设计化学电池
例3:根据反应:Fe+Cu2+=Fe2++Cu,设计两个原电池,画出装置图,写出电极反应式(要求其中一个含盐桥)。
练习
1、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A、a>b>c>d B、a>c>d>b
C、c>a>b>d D、b>d>c>a
2、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A、铁圈和银圈左右摇摆不定;
B、保持平衡状态;
C、铁圈向下倾斜;
D、银圈向下倾斜。
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。
























