课程内容
《电解池(1)》
思考:
1、通电前,氯化铜溶液中有哪些离子?如何运动?通电后,阴、阳离子的运动有改变吗?
2、当离子定向移动到电极表面时,发生的是什么类型的反应?写出两电极反应和总的化学方程式。
3、通电后,回路中离子及电子的运动方向怎样?
实验微观解释
①通电前:CuCl2=Cu2++2Cl-,Cu2+、Cl-为自由移动的离子;
通电后:Cu2+移向阴极得到电子,Cl-移向阳极失去电子;
②电极反应:
阳极:2Cl--2e-=Cl2↑(氧化反应)
阴极:Cu2++2e-=Cu(还原反应)
电解
总反应式:CuCl2====Cu+Cl2↑
一、电解原理
电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
①电流是发生反应的动力(使不能自发进行的反应顺利进行)。
②阴阳离子做定向移动的导电过程,也就是两极发生氧化还原的过程,即电解质溶液的导电过程即为电解过程。
③电流是直流电。
④在电解过程中电能转化为化学能。
二、电解池:
1、定义:电能转化为化学能的装置
2、形成电解池的条件:
(1)与电源相连的两个电极
(2)电解质溶液或熔化电解质
(3)形成闭合回路
3、电极名称:
阴极:与电源负极相连,进电子,还原反应
阳极:与电源正极相连,出电子,氧化反应
4、电极材科
惰性电极:C、Pt、Au不发生反应
活性电极:Ag及以前金属,作阳极则溶解
5、电解时离子放电顺序
阳离子得到电子或阴离子失去电子使离子电荷降低的过程叫做放电。
①阴极:阳离子放电,金属活动顺序的反顺序
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+
注意(一)Fe3+>Cu2+;(二)电镀时:受离子浓度影响Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Fe2+>Zn2+>H+
②阳极:活性电极(Ag以前),电极失电子
惰性电极(Pt、Au、石墨),阴离子放电S2->I->Br->Cl->OH->含氧酸根>F-
6、电解时电极反应式、总反应式
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑
2H2O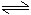 2H++2OH-
2H++2OH-
总反应:
通电
2H2O+2Cl-====H2↑+Cl2↑+2OH-
注意:
(1)得失电子数目一致。
(2)两极放电的H+或OH-来源于水时,总反应的反应物书写水分子。
(3)注明条件“通电”。
书写电解硫酸铜溶液的电极反应式和总反应式
阴极:2Cu2++4e-=2Cu
阳极:4OH--4e-=2H2O+O2↑
4H2O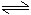 4H++4OH-
4H++4OH-
总反应: 通电
2Cu2++2H2O====2Cu+4H++O2↑
练习
(1)写出以碳棒作电极电解饱和氯化钠溶液的电极反应式。
(2)写出以铜棒作电极电解氯化铜溶液的电极反应式。
7、用惰性电极电解电解质溶液的规律
电解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4)的电解。
电解电解质型:无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2)溶液的电解。
电解质和水同时被电解型:
A、放氢生碱型:活泼金属的无氧酸盐(如NaCl)溶液的电解
B、放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3)溶液的电解
电解池与原电池的区别:
电解池
原电池
能量转换
电能转化为化学能
化学能转化为电能
离子的迁移方向
阳离子向阴极迁移,阴离子向阳极迁移
阳离子向正极迁移,阴离子向负极迁移
发生氧化反应的电极
阳极(接电源正极)
负极
发生还原反应的电极
阴极(接电源负极)
正极
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。























