课程内容
《电解池(2)》 阳极 Zn-2e-=Zn2+
7、用惰性电极电解电解质溶液的规律
电解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4)的电解。
电解电解质型:无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2)溶液的电解。
电解质和水同时被电解型:
A、放氢生碱型:活泼金属的无氧酸盐(如NaCl)溶液的电解
B、放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3)溶液的电解
三、电解原理的应用
1、铜的电解精炼
(1)粗铜含的杂质:Zn、Fe、Ni、Ag、Au等
(2)粗铜的精炼
粗铜做阳极,纯铜做阴极,CuSO4溶液做电解液
(3)电极反应式
(4)阳极上比铜不活泼的金属,沉积于阳极底部,成为阳极泥,可以提炼金、银等贵重金属。
2、电镀
(1)概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
(2)电镀池形成条件
①镀件作阴极
②镀层金属作阳极
③含镀层金属阳离子的盐溶液作电解液
(3)电镀的特点
电镀液的组成及酸碱性基本保持不变
阅读了解
为了使镀层致密、坚固、光滑,还要采取一些措拖:
(1)镀件进行抛光和清洗,使镀件洁净、光滑;
(2)电镀液的离子浓度始终保持恒定,常将电镀液制成络合物;
(3)电镀时,要不断搅拌,并控制温度、电流、电压、使电镀液pH在一定范围内。
在电镀工业的废水中常含有剧毒物质,如氰化物,重金属离子等,减少电镀污染的途径:
(1)电镀废水经过处理,回收其中有用成分,把有毒有害物质的浓度降低到符合工业废水的排放标准。
(2)改进电镀工艺,尽量使用污染少的原料,如采用无氰电镀等。
比较:精炼铜、电镀铜的区别
电镀铜
精炼铜
形成条件
镀层金属作阳极,镀件做阴极,电镀液必须含有镀层金属的离子
粗铜金属作阳极,精铜作阴极,CuSO4溶液作电解液
电极反应
阳极 Zn-2e-=Zn2+
阴极 Zn2++2e-=Zn
Cu-2e-=Cu2+
阴极 Cu2++2e-=Cu
溶液变化
电镀液的浓度不变
溶液中溶质浓度基本不变,定期除杂质
3、电解饱和氯化钠溶液
电解前应除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质离子。
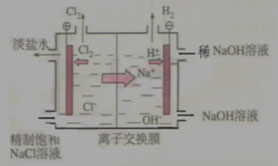
离子交换膜法电解原理示意图
4、铝的冶炼
(1)电解AlCl3溶液能否得到单质铝?
(2)电解熔融状态的AlO3能否得到单质铝?
(3)电解Al2O3的电极反应和电解总式?
冶炼其它活泼金属(钾、钙、钠、镁等)
练习1:在50mL0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:
(1)若两极均为铜片,试说明电解过程中溶液溶质浓度将怎样变化_______。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是___________。
(3)如果两极均为铜片且不考虑H+在阴极上放电,当电路中有0.01mol电子通过时,阴极增重______g,阴极上的电极反应式是___________。
此内容正在抓紧时间编辑中,请耐心等待
刘老师
女,中教高级职称
优秀教师,丰富的教学实践经验,所带过的学生进步非常大,深受学生的喜欢和家长的好评。























